
ГИДРАТАЦИЯ СИЛИКАТОВ КАЛЬЦИЯ
В ряду силикатов кальция C3S, C2S, C3S2 и CS достаточно четко выраженными вяжущими свойствами обладают два первых ортосиликата. Природу вяжущих свойств силикатов кальция в числе первых описали Ю. М. Бутт и В. Е. Каушанский, которые выделили кристалоохимическую особенность строения решеток гидратационно активных фаз — наличие в структуре изолированных кремнекислородных тетраэдров. Вторым важным условием, по их мнению, является нарушение в строении кристаллических решеток, приводящее к возрастанию свободной энергии и метастабильности безводных фаз. Вместе с тем, указанные критерии не раскрывают различий в скорости взаимодействия силикатов кальция с водой. Причина этого может быть установлена только при анализе кристаллических структур, что позволяет установить влияние расположения атомов на реакционную способность минералов. Очевидно, этот фактор является определяющим в гидратационной активности вяжущих, так как при измельчении в результате помола или разупорядочении структуры примесными атомами скорость реакции изменяется. В связи с этим возникает вопрос о структурной природе их гидратационной (химической) активности.
С этой целью К. Джост и Б. Циммер оценили взаимосвязь между кристаллической структурой силикатов кальция и реакционной способностью по отношению к воде: установлено, что все гидратационно-активные фазы являются ортосиликатными, а силикаты с полимерными тетраэдрами инертны. По мнению этих авторов, ранее принятые критерии гидратационной активности не всегда соответствуют действительности. Так, длина связей и углы в [Si04]4-тетраэдрах не оказывают решающего влияния на гидратационную активность. В структурах цементных силикатов отсутствуют пустоты, в которые могут входить молекулы воды. При этом плотность ие играет существенной роли.
На основании такого кристаллохимического подхода К. Джост и Б. Циммер выдвинули гипотезу механизма взаимодействия силикатов кальция с водой. В негидратированных кристаллах кулоновские силы отталкивания между ионом Са2+ и соседними с ним катионами сбалансированы. Однако при нарушениях структуры, что имеет место при реакции с водой, проявляется тенденция к увеличению сил отталкивания. Когда на поверхности кристалла из полиэдра СаО, освобождается ион Са2+ и при этом образуются ОН~ и Si—ОН, то в следующем полиэдре СаО валентные усилия связей не скомпенсированы, и ион Са2+ перемещается на место ранее освободившегося. При наличии структурных построек из бесконечных Са-полиэдров, связанных общими гранями, эти процессы облегчаются. Влияние полиморфизма и примесных атомов на гндратационную активность силикатов кальция является второстепенным по сравнению со структурными факторами.
Следует отметить, что такая картина процесса гидратации не является достаточно полной, так как неясно, чем обусловлено различие в скорости гидратации, а также высокая активности СаО, в котором Са-октаэдры связаны только ребрами. Нет общих граней между Са-полиэдрами и в гидратационно-активных алюминатах и алюмоферритах кальция. Кроме того, анионы в их составе имеют не островное, а цепочечное или каркасное строение. Очевидно, наряду с указанным механизмом на процессы гидратации вяжущих материалов налагаются и другие элементарные акты взаимодействий. Анализ последних расшифровок кристаллической структуры свидетельствует о значительной анизотропии химических связей в Са-полиэдрах. При этом максимальная анизотропия наблюдается в семивершинниках как для триклинной (Н. И. Головастиков и др., 1975 г.), так и для ромбоэдрической (А. М. Ильинец. и др., 1985 г.) модификаций.
Изучение формального (по Полингу) и локального (истинного) баланса валентностей позволяет выявить в кристаллических структурах цементных минералов анионы кислорода, недосыщенные и пересыщенные положительными валентными усилиями катионов. Формальный баланс валентностей является слишком грубым приближением, и весьма часто использовать его в качестве критерия оказывается недостаточным, поскольку он предполагает равноценность и равновеликость всех химических связей. Вместе с тем, даже в пределах одного координационного полиэдра межатомные расстояния могут существенно разниться. Иными словами, более правильную оценку можно получить, рассчитывая локальный баланс валентностей на анионах кислорода. В механизме общего и локального балансов валентностей важнейшую роль играют атомы водорода, что определяется двумя основными причинами [3]. Во-первых, в отношении протона не действуют известные геометрические факторы, лимитирующие структурные возможности других катионов. Во-вторых, валентный пай, передаваемый протоном аниону, весьма велик, несмотря на минимальный положительный заряд протона. Это обусловлено низким координационным числом последнего.
Молекула воды может участвовать в четырех связях, из них в двух связях выступает в качестве донора и в двух — в качестве акцептора про тона [14]. Поэтому недосыщенные положительным зарядом катионов анионы кислорода в структурах цементных минералов при гидратации можно представить как акцепторы протона. На них также наиболее вероятна хемосорбция молекул вод. Возникающая водородная связь является частным случаем донорно-акцепторной. При этом происходит химическое насыщение внешней сферы кислородосодержащих комплексов МеО, что, по данным [15], вызывает резкое возрастание ионности связи Me—О и должно приводить к перераспределению валентных усилий внутри полиэдров, а в результате — к изменению локального баланса валентностей кристаллической структуры и к структурным превращениям при гидратации цементных минералов.
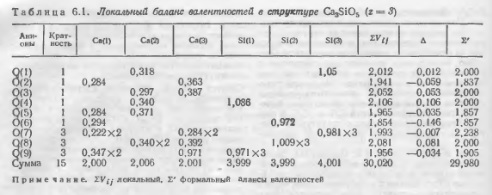
Расчеты балансов на три формульные единицы для ромбоэдрического C3S приведены в табл. 6.1. Так, 60 % атомов кислорода недосыщены, а 40 % пересыщены. Характерно, что недоеыщенными являются атомы О (2), О (5) и О (9), сочленяющие друг с другом тройки семивершинннков. Эти же полиэдры имеют большую вершину О (6), которая также сильно недосыщена. Согласно правилу Полинга наличие общих граней у Са-полиэдров приводит к сильному возрастанию силы отталкивания между катионами, что делает структуру неустойчивой. Напряженность, избыток потенциальной энергии структуры также создают ребра 0(1) — О (4), являющиеся общими для трех Са (2)-октаэдров.
Структурные изменения в составе гидросиликатной фазы камня C3S подтверждаются методами термического и ИК-спектроскопического анализов [6]. Так, на кривых ДТА эндоэффект, обусловленный выделением воды из гидросиликатов, с возрастом твердения смещается от 120 °С через 6 ч до 170 °С через 10 лет. На ИК- спектрах с возрастом твердения наблюдается постоянное смещение максимума основной полосы поглощения при 938 см-1 до 989 см, что свидетельствует о полимеризации кремнекислородных радикалов.
В процессах гидратации цементов несомненно важная роль принадлежит механизму диссоциативной адсорбции молекул воды на активных центрах поверхности, получившему развитие в работах М. М. Сычева. При этом наряду с протоном в реакционной зоне образуются группы ОН-, которые в пределах двойного электрического слоя значительно изменяют pH жидкой фазы. Характерно, что простейшими устойчивыми гидратами в водных растворах кислот и оснований являются не ионы Н3O+ и ОН-, а комплексные ионы Н5О2+ и Н3О2- [18]. Устойчивость последних обусловлена наличием заряженного фрагмента О-Н-О, протон которого находится в центре системы лигандов, соединенных водородными связями. В таких растворах вследствие эстафетного механизма наблюдается аномально высокая подвижность протона и иона гидроксила.
Так как протоны из молекул воды на поверхности мигрируют внутрь исходного кристалла, закрепляясь на акцепторах с образованием устойчивых частнц ОН-, то в противоположном направлении происходит перемещение атомов кальция и, в меньшей степени, кремния наружу в раствор через продукты гидратации [19]. В растворах с большой концентрацией гидроксид-ионов повышается вероятность существования крупных гидратных комплексов, кристаллизующихся в гидроксид кальция в виде плотно-упакованной гексагональной постройки из ОН анионов, в которой катионы кальция занимают половину октаэдрических пустот.
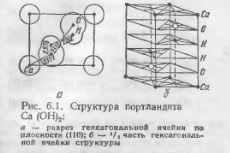
В зависимости от условий твердения в порах цементного камня на различных стадиях твердения реализуются два пути кристаллизации гидроксида кальция (природный минерал — портландит). В сильно пересыщенных растворах кристаллизация идет в результате образования в объеме пакетов Са(ОН)2 с последующим осаждением га на плоскость (0001) растущего призматического кристалла. Прн малом пересыщении атомы попадают на поверхность кристалла к местам наиболее прочного встраивания (дислокациям, вакансиям) и развитие получают плоские гексагональные пластины. При реальном кристаллообразовании портландцемента в цементном камне оба механизма часто налагаются за счет градиента концентрации ионов Са2+ и ОН- по диаметру поры. Портланднт имеет слоистую структуру «бруситового» типа. Его решетка построена из трехслойных пакетов НО—Са—ОН (рис. 6.1), представляющих собой как бы гигантскую двумерную молекулу, n-кратную формуле портландита. Силы сцепления внутри «тройных» слоев носят ионный характер. Связь между соседними пакетами является вандерваальсовой. Она значительно слабее ионной, поэтому в таких «пакетных» структурах отмечается пониженная прочность в параллельных слоям плоскостях (легкая раскалываемость, скольжение).
Характерными плоскостями для кристаллов портландита являются плоскость (0001), которая проходит параллельно плоскости портландитовых пакетов и перпендикулярно к слоям — плоскость (1110), соответствующая боковым граням кристаллов. Кроме того, по плоскостям (0001) кристаллов портландита располагаются одноименные анионы ОН-, а вдоль плоскостей (1110) — разноименные ионы Са2+ и ОН-. Такие структурные особенности строения кристаллов портландита обусловливают повышенную растворимость игольчатых кристаллов по сравнению с пластинчатыми. На эти процессы в цементном камне, как правило, налагаются процессы геометрического отбора растущих кристаллов. Оба фактора приводят к тому, что гексагональные пластинчатые кристаллы с увеличением возраста твердения становятся одними из основных элементов кристаллической структуры алитового цементного камня и в значительной мере определяют его строительно-технические свойства, в частности, ограничение прочности за счет спайности кристаллов Са (ОН)2 по плоскостям (0001).
Таким образом, из кристаллохимического аспекта гидратации C3S следует, что при взаимодействии минерала с водой сочетаются оба механизма гидратации — твердо- и жидкофазовый. Первоначально происходит топохимическая реакция протонизации недонасыщенных атомов кислорода в структуре C3S.
Характер протекания химических реакций при гидратации силикатов кальция обсуждался на 7 Международном конгрессе по химии цемента (Рио-де-Жанейро, 1986 г.). X. Ф. В. Тейлор выделяет [19] ранний, средний (до 4—6 ч) и поздний периоды гидратации.
Следует отметить, что основная масса C3S гидратируется в поздний период. Согласно X. Ф В. Тейлору, в это время безводные фазы, оставшиеся в больших зернах, не контактируют с молекулами воды, кроме молекул, содержащихся в окружающем продукте, главным образом, в порах и межслойных зазорах. В этих условиях механизм растворения срабатывает более медленно, чем в начале взаимодействия или чем топохимический механизм. Микроструктурные данные указывают на следующий механизм гидратации C3S в позднем периоде реакции (рис. 6.2): граница раздела распространяется в зерно по мере протекания реакции, отсутствует диффузия молекул воды через «внутренний» или «поздний» продукт, ионы Н+ перемещаются от одного атома О к другому внутри «позднего» продукта (возможно молекулы воды), пока они не достигнут поверхности, подвергающейся воздействию так же сильно, как если бы она была в контакте с водным раствором. На поверхности раздела существует узкая зона, в которой требуется существенная перегруппировка атомов, чтобы имело место превращение C3S в CSH. Атомы кальция и кремния мигрируют наружу через «поздний» продукт и поступают в Са (ОН)2 или «наружный» продукт CSH. При этом атомы кислорода перемещаются в незначительном диапазоне. Полагают, что кремний мигрирует путем ряда перемещений через поверхности тетраэдров (от заполненных к пустым), и этот же механизм обеспечивает изменение типа силикатного аниона как во время, так и после формирования CSH.
